(通讯员:胡丹蕾、孟奎宇)近日,我校性爱网
精准兽药创制团队在炎症性肠病和胞内MRSA感染的靶向治疗领域实现了重要突破。两项创新性研究成果分别发表于国际知名期刊《Journal of Controlled Release》和《Theranostics》,为相关疾病的精准用药提供了新思路。
常规药物在疾病治疗过程中往往存在靶向性差、副作用大等局限。针对这一共性难题,团队聚焦“精准递送”,分别开发出口服多功能靶向胶珠与胞内病原菌靶向纳米递送系统,显著提升了药物在病灶部位的富集与释放效率以及对病原的靶向性。
炎症性肠病和腹泻是困扰人类与畜禽健康的常见顽疾,而现有抗生素、糖皮质激素等药物常面临靶向性差、副作用大且易导致肠道菌群失调等瓶颈。团队利用丁酸和天然化合物芹菜素协同抑制丝氨酸/苏氨酸蛋白激酶 (CK2)和阻断p65磷酸化抑制NF-κB炎症通路,激活过氧化物酶体增殖物激活受体γ(PPAR-γ)介导的β-氧化代谢转变,促进专性厌氧菌(拟杆菌门)增殖的同时抑制肠杆菌科(变形菌门)以调控肠道菌群平衡,实现抗炎、肠道菌群调节和肠道屏障修复的三重治疗作用。为克服丁酸难闻臭味和提高两者对肠炎的靶向性,巧妙将丁酸与芹菜素合成为前药“芹菜素丁酸酯”,利用芹菜素与CK2的互作增强对炎症的靶向性。为避免芹菜素丁酸酯在消化道前段的吸收,采用抗坏血酸棕榈酸酯与海藻酸盐制备成胶珠,使其稳定过胃后在回结肠部位崩解为带负电荷的水凝胶(-34.5 mV),经电荷介导黏附至正电荷炎性蛋白聚集的肠炎病灶,并利用炎症部位过表达的酯酶触发凝胶响应性释放和芹菜素丁酸酯的酯解,实现肠炎靶向治疗(图1)。动物试验表明,该胶珠不仅显著恢复炎性肠道的完整性和微生物菌群平衡,还在半剂量、延长给药间隔的条件下,疗效仍优于常规药物,展现出良好的临床转化前景。本研究成果将为炎症性肠病和畜禽腹泻疾病的治疗提供新的策略。
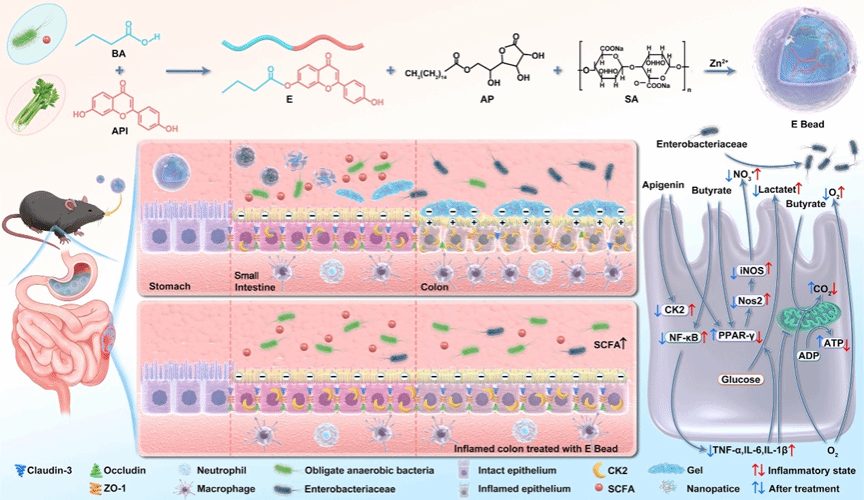
图1 芹菜素丁酸酯抗坏血酸棕榈酸酯与海藻酸盐胶珠的制备原理和靶向治疗模式图
由于MRSA具有胞内寄生和高度耐药的双重特性,传统药物难以有效清除,导致其感染性疾病一直是临床治疗的重大挑战。针对这一治疗难题,团队另辟蹊径,利用金黄色葡萄球菌与宿主的铁元素代谢竞争机制,基于镓卟啉分子陷阱设计了一种新型“特洛马伊”精准纳米递送系统,实现对感染部位、感染细胞和胞内MRSA的三重靶向识别。铁作为血红素的关键组分,对宿主和微生物存活都至关重要。在MRSA感染过程中,感染细胞大量分泌血红素结合蛋白(Hpx)和触珠蛋白(Hpg),与血红素形成稳定复合物后,通过过表达的低密度脂蛋白受体相关蛋白1(LRP1)和CD163受体进行高效内吞,限制MRSA对铁的获取。为应对宿主封锁,MRSA通过激活铁反应性表面决定簇(Isd)系统实现铁的补偿性摄取。基于MRSA和感染细胞对铁元素的双重竞争机制,团队合成了一种对感染部位的分泌蛋白Hpg/Hpx、感染细胞过表达的CD163/LRP1受体以及细菌Isd系统具有三重靶向作用的血红素类似物-镓卟啉(GaPR)。将GaPR与光敏剂TCPP作为有机配体制备成锆基卟啉有机金属框架(GaPR-PCN),利用GaPR-PCN的空隙结构荷载左氧氟沙星(Lev)制备成可同时抑制细菌DNA旋转酶、破坏铁代谢途径和光动力杀伤的多功能精准靶向递送平台。为进一步提升其靶向性和生物相容性,研究团队在Lev-GaPR-PCN表面利用ROS敏感的硫酮连接键(TK)修饰透明质酸(HA),制备成HA-Lev-GaPR-PCN。该系统在血液循环中具有“隐形”特性,在感染部位过表达的ROS或透明质酸酶触发智能释药,暴露Lev-GaPR-PCN的配体GaPR,使其与Hpx/Hpg形成复合物,靶向感染细胞,并逃逸溶酶体和高效锚定胞内MRSA。该递送系统兼具靶向识别感染部位、穿透细胞膜和锚定胞内细菌的能力,并联合左氧氟沙星与光动力疗法,实现三重协同杀菌,显著延缓耐药性的产生。该系统突破了常规抗菌药物难以有效抵达细胞内感染灶的技术瓶颈,为胞内耐药菌的感染治疗提供了创新手段。
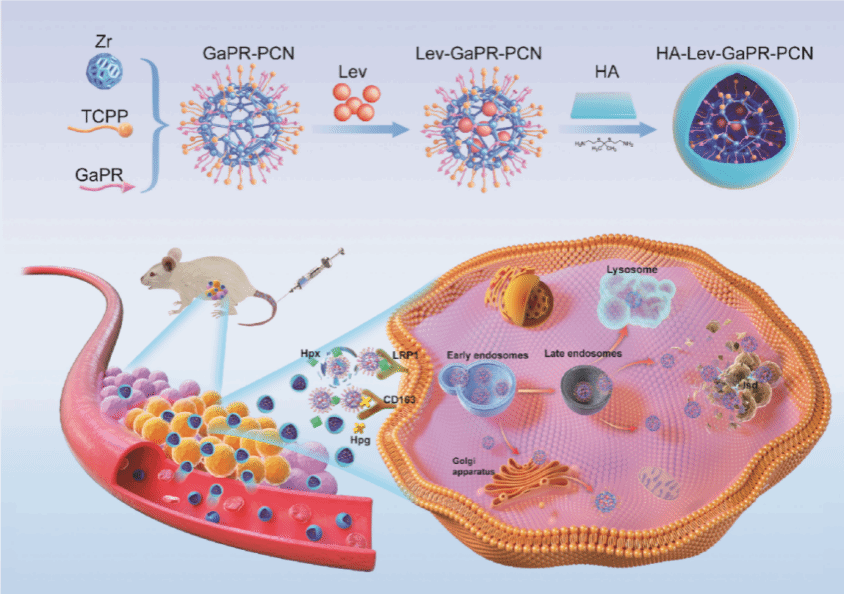
图2 HA-Lev-GaPR-PCN递送系统的制备原理和三重靶向示意图
两项研究成果均体现了“精准递送”的先进理念,不仅为畜禽肠道疾病和胞内耐药菌感染防控提供了新方案,也为人类相关疾病的治疗策略开发提供了有益借鉴。性爱网
博士胡丹蕾和陈冬梅教授为论文1的共同第一作者,博士生孟奎宇为论文2的第一作者,谢书宇教授为两篇论文的通讯作者。该研究获得国家重点研发计划(2022YFD1300705)、国家自然科学基金(32273064、32373068、32373068)和校自主创新基金(2662023DKPY004)等项目的资助。
审核人:谢书宇
论文1链接://www.sciencedirect.com/science/article/pii/S0168365925008521
论文2链接://www.thno.org/v15p9326.htm

